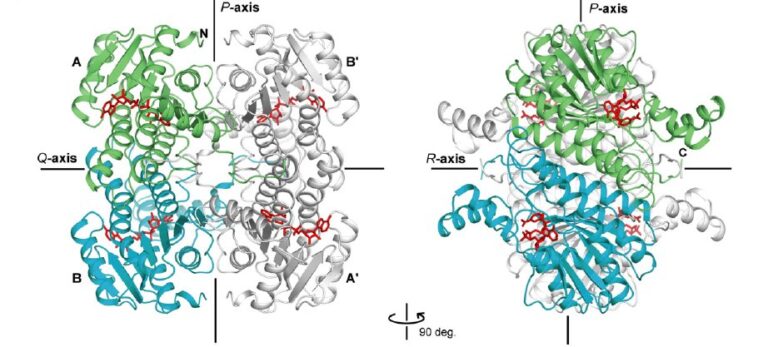
AldTは、グルコースよりもマンノースに対して強い活性を示すグルコース脱水素酵素のホモログであり、これまでにこのような基質特異性を持つ酵素はクローニングされていません。補因子としてNADPよりもNADが適していることからも、単糖を定量する臨床検査においてAldTが有用な酵素となりうることが示唆されました。私たちはAldTの基質結合状態および補因子結合状態の結晶構造解析を行い、基質認識・触媒メカニズムについて明らかにしました。構造解析の結果、AldTの単糖認識には、活性部位に存在するグルタミン酸残基が重要な役割を担っていること、また活性に多大な影響を与える特徴的なC末端テール構造の存在が明らかになりました。これら構造解析から得られた情報をもとに、AldTの高活性型変異体・基質特異性改変型変異体の取得を目指しています。
関連論文
- Yasutake, Y., Nishiya, Y., Tamura, N., Tamura, T. (2007) Structural insights into unique substrate selectivity of Thermoplasma acidophilum D-aldohexose dehydrogenase. J. Mol. Biol., 367(4), 1034-1046.

