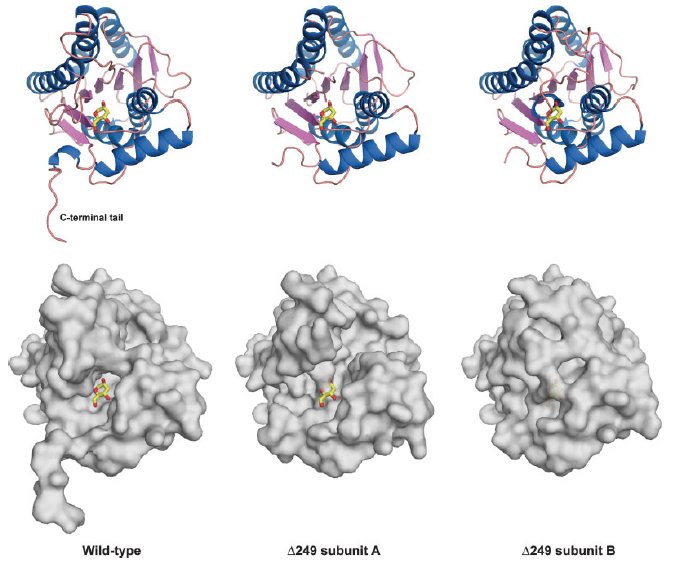
野生型AldTの立体構造解析では、酵素の単糖識別機構の詳細情報を得るだけでなく、球状AldTサブユニット構造から突出した、ユニークなC末端テール部位が存在していることがわかりました。活性型四量体構造の中においては、この部位は隣のサブユニットの基質認識ポケットの入り口を覆うように存在しており、基質との直接の相互作用はないものの、基質の出入りや活性部位構造の安定化に関わるであろうことが示唆されました。そこで、C末端削除変異体を複数種類作成し、それらの活性を測定することで、この構造部位の機能的役割を明らかにすることを試みました。活性測定の結果、野生型AldT(1-255)からわずか2残基欠失させたAldT-delta253において活性が大きく低下し、6残基を欠失させたAldT-delta249においては、いずれの糖に対しても活性を示さなくなることが明らかになりました。すなわちこのC末端テール構造は活性に必須の構造部位であると言えます。私たちはさらに活性を示さないAldT-delta249の結晶構造解析を行い、失活した酵素の構造から、このC末端テール部位の構造的役割の解明を試みました。
関連論文
- Nishioka, T., Yasutake, Y., Nishiya, Y., Tamura, N., Tamura, T. (2009) C-terminal tail derived from the neighboring subunit is critical for the activity of Thermoplasma acidophilum D-aldohexose dehydrogenase. Proteins, 74(4), 801-807.

