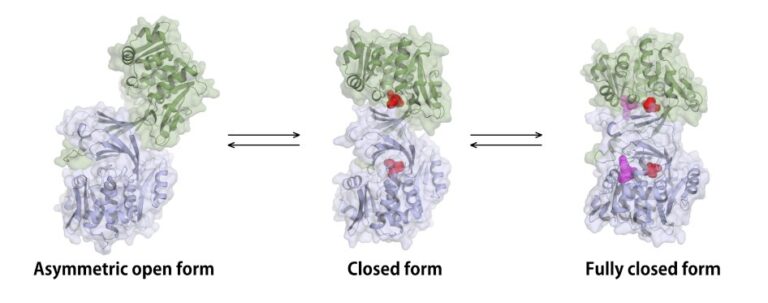
グラム陰性細菌Burkholderia thailandensis由来ヌクレオシドキナーゼ(BthNK)は、Mg2+およびATP依存的に様々なヌクレオシドに対してリン酸化活性を示します。本酵素の広い基質特異性を利用し、現在臨床現場において免疫抑制剤ミゾリビン(プリンヌクレオシドアナログ)の血中濃度測定が実用化されています。BthNKはphosphofructokinase B (Pfk-B) ファミリーに属する酵素であり、これまでに多くのPfk-B酵素の構造機能解析が行われています。しかしながらBthNK以外にミゾリビンに対し高いリン酸化活性を示す酵素は見つかっていませんでした。例えばBthNKとの間で活性部位アミノ酸残基がよく保存されているMycobacterium由来アデノシンキナーゼは、アデノシン以外のヌクレオシドをリン酸化することができません。BthNKに広い基質特異性を与える構造的要因を調べるため、本酵素の構造機能解を行いました。BthNKの構造は、リガンドフリー、イノシン複合体、イノシン-ADP複合体、ミゾリビン-ADP複合体、およびAMP-Mg-AMP複合体の5状態での構造解析に成功し、これら構造解析の結果、open、closed、fully closedの3種のコンフォメーションが観察されました。このうちfully closed formはこれまでPfk-B酵素で知られていない新規のコンフォメーションで、SN2反応によるリン酸基転移反応のメカニズムを合理的に説明することを可能としました。また、基質複合体構造においてヌクレオシドの塩基部位の一部が溶媒に露出している状態が観察され、これがBthNKの広い基質特異性発現の要因であると考えられました。この領域に変異導入を行うことで、BthNKに高いアデノシン特異性を与えることにも成功しました。すなわち、この領域を改変することで、自在に基質特異性を変化させられる可能性が示されました。
関連論文
- Yasutake, Y., Ota, H., Hino, E., Sakasegawa, S., Tamura, T. (2011) Structures of Burkholderia thailandensis nucleoside kinase: implications for the catalytic mechanism and nucleoside selectivity. Acta Crystallogr., D67(11), 945-956.

