Bifunctional quorum-quenching and antibiotic-acylase MacQ
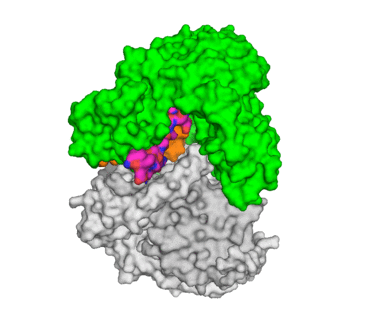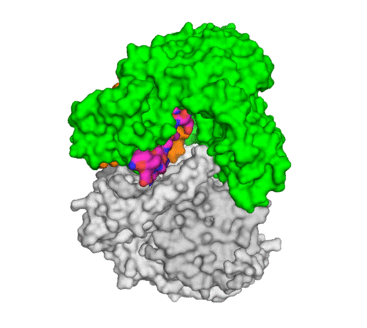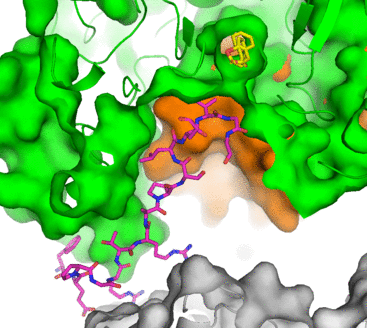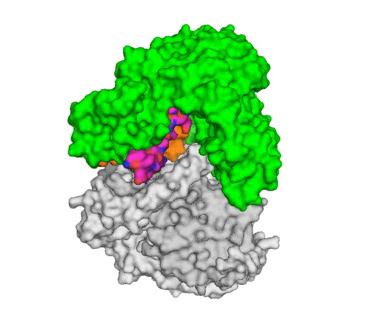
Acidovorax sp. MR-S7 株から分離された MacQ 酵素は、細菌間シグナル物質であるN-acyl-L-homoserine lacton (AHL) を分解すると共に 、β-ラクタム系抗生物質 Penicillin G に対する分解活性も有しています。すなわちMacQは、細菌の細胞間コミュニケーションに干渉すると同時に、多剤耐性を与える興味深い酵素です。このような性質を持つ MacQ の基質認識機構を明らかにするため、本MacQ酵素のX線結晶構造解析を行いました。その結果、MacQ は自己開裂活性により3本のポリペプチドに分かれたモノマー同士が向かい合って会合したヘテロ多量体を形成し、この高次の会合により籠状の構造を形成することが分かりました。また構造研究が進んでいる近縁の AHL分解酵素 PvdQ の結晶構造と比較すると、自己開裂後に脱離するはずのスペーサーポリペプチド鎖が、籠状構造の内部に残存し、籠内部の壁面に沿って定まった構造を取っていることが明らかになりました。さらに興味深いことに、スペーサーは籠内部にある活性ポケットに接近し、基質に接触できる位置にあることが分かりました。すなわち、残存していたスペーサーが本酵素の二機能性に関係している可能性が示唆されます。スペーサー領域には、類縁酵素のアミノ酸配列との間にほとんど相同性が見られません。つまり、スペーサー鎖の残留は、祖先から受け継いだものではなく、進化の過程で獲得したものであると推測されます。