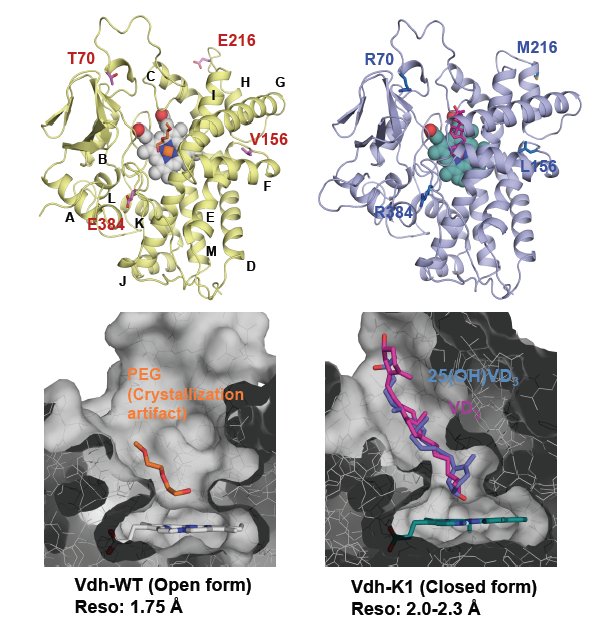
P450 Vdh (CYP107BR1)の構造
放線菌Psudonocardia autotrophicaは、ビタミンD3の1位および25位炭素を水酸化し、活性型ビタミンD3へと変換できます。活性型ビタミンD3は骨粗鬆症等の治療薬であり、現在本バクテリアを用いた微生物変換により活性型ビタミンD3が生産されています。この水酸化反応は、ビタミンD3水酸化酵素(P450 Vdh)が担っています。私たちはVdhのさらなる活性向上に向けて変異導入を行い、基質結合親和性および活性が飛躍的に向上した4重変異体(Vdh-K1)を取得しました。このVdh-K1に見出された4カ所の変異箇所は、活性部位からいずれも遠く離れていました。そこで性能向上の構造的要因を探るため、野生型Vdh(Vdh-WT)およびVdh-K1の結晶構造解析を行ったところ、変異が導入されることで構造変化の平衡がクローズ側(基質結合状態の構造)に大きく移動したことが示唆されました。各々の単一変異体では活性および基質結合親和性の大幅な向上は見られないため、これら4変異は活性向上に協調的に作用していると推測されます。わずかな変異によって活性が劇的に変化する現象はP450において過去にも報告されており、P450が自然界において次々に遭遇する多様な物質に迅速に適応し、それらを解毒代謝する能力を獲得していくメカニズムかもしれません。
関連論文
- Yasutake Y, Fujii Y, Nishioka T, Cheon W-K, Arisawa A & Tamura T. (2010) Structural evidence for the enhancement of sequential vitamin D3 hydroxylation activities by directed evolution of cytochrome P450 vitamin D3 hydroxylase. J. Biol. Chem., 285(41), 31193-31201. [PDB codes, 3a4g, 3a4h, 3a4z, 3a50 & 3a51]
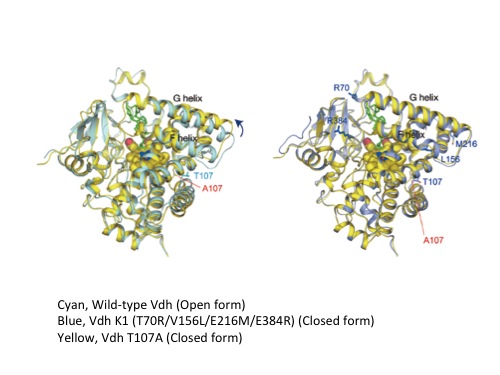
P450 Vdh (CYP107BR1)の活性向上変異体取得
P450分子は、フェレドキシンおよびフェレドキシン還元酵素から電子を受け取り、一連の酸素原子添加反応に用いています。Vdhと本来カップルするフェレドキシン蛋白質はP. autotrophica細胞内に存在するはずですが、特定されていません。これまでの研究から、Acinetobacter sp. OC4のフェレドキシン(AciB)及びフェレドキシン還元酵素(AciC)がVdhへの電子伝達に有用であることが分かっています。そこで、AciBが結合すると予想されるVdhの分子表面に変異を導入し、より電子の受け渡しがスムースに進むような変異体の取得を行ったところ、野生型に比べて約80倍活性が向上したT107A変異体を得る事に成功しました。基質結合スペクトルアッセイ及びAciBとの相互作用解析を行ったところ、基質との結合能は野生型とほとんど変わらない一方、AciBとの相互作用能が向上している事がわか理ました。そこでT107A変異体の結晶構造解析を行なったところ、進化工学によって取得されたVdh-K1変異体とほぼ同様な大規模な構造変化が観察されました。構造変化によってVdh分子表面の電荷分布が大きく変化する事から、この構造変化はレドックスパートナー蛋白質との相互作用能向上に寄与している事が示唆されます。
関連論文
- Yasutake Y, Nishioka T, Imoto N & Tamura T. (2013) A single mutation at the ferredoxin binding site of P450 Vdh enables efficient biocatalytic production of 25-hydroxyvitamin D3. ChemBioChem., 14(17), 2284-2291. [PDB code, 3vrm]
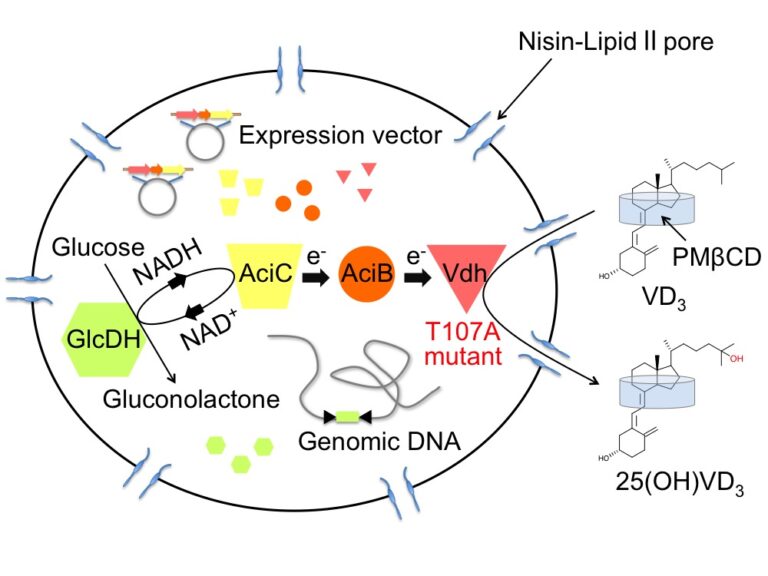
ロドコッカス死細胞を用いたビタミンD変換系への応用
私たちは、上記の高活性Vdh変異体をAciBCと共にロドコッカス細胞内で発現させ、また抗菌物質であるナイシンによって細胞に孔を形成することにより、非常に効率的に水酸化ビタミンDを生産することに成功しました。ナイシンは細胞膜に穴を開けることで細胞を死たらしめますが、完全に溶菌することはないため、高発現蛋白質を閉じ込めた触媒カセットとして機能させることができます。他の有用酵素を用いた場合にも、ナイシン処理細胞のシステムによってより効率的な物質変換の達成が期待されます。
関連論文
- Yasutake Y, Nishioka T, Imoto N & Tamura T. (2013) A single mutation at the ferredoxin binding site of P450 Vdh enables efficient biocatalytic production of 25-hydroxyvitamin D3. ChemBioChem., 14(17), 2284-2291. [PDB code, 3vrm]
- 安武義晃、田村具博 (2011)「微生物変換によるビタミンD3の効率的生産〜分子の改良から細胞膜改変までの包括的アプローチ〜」シンセシオロジー 4(4), 222-229.
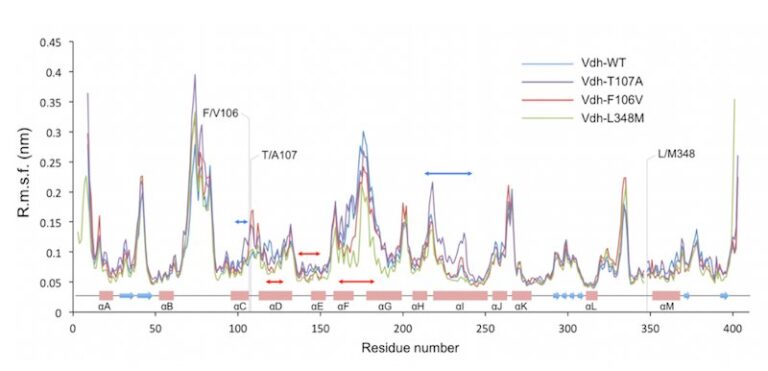
遠位変異による劇的な活性変化の要因を分子の動的性質から探る
私たちはこれまでに、進化工学や部位指定変異導入法により、活性が変化した多数のVdh変異体を取得してきました。その中には、単一変異によって劇的に活性レベルが変化するような変異体が含まれています。例えば、T107Aは約80倍活性が向上し、F106VやL348Mは活性が完全に消失します。これらの変異箇所はいずれも、P450の機能部位とは直接関係しない、つまり活性部位から離れた箇所に存在します。このような活性レベルの劇的な変化がどのような仕組みで生じるのかを明らかにするため、活性消失変異体の結晶構造を解析するとともに、野生型および活性向上/消失変異体の分子動力学シミュレーションを行いました。その結果、変異により分子の動的性質が変化する領域の存在が示唆され、またオープン/クローズの全体構造変化に相関する310/αヘリックス構造の変化が観察されました。Vdhは溶液中でオープンとクローズ構造の平衡があると考えられ、活性向上変異は、この平衡をクローズ方向に大きく移動させ、また反対に失活変異はオープン側に移動させる効果を示していると考えられます。
関連論文
- Yasutake Y, Kameda T & Tamura T. (2017) Structural insights into the mechanism of the drastic changes in enzymatic activity of the cytochrome P450 vitamin D3 hydroxylase (CYP107BR1) caused by a mutation distant from the active site. Acta Crystallogr. Sect. F, 73(5), 266-275. [PubMed] [PDB codes: 5gnl & 5gnm]

