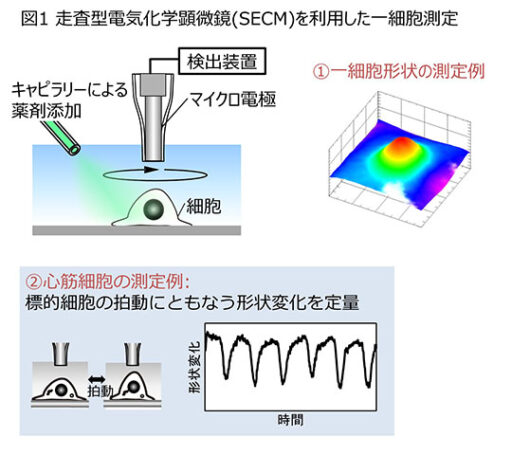
走査型電気化学顕微鏡(SECM)は、細胞と同程度のサイズのマイクロ電極をスキャンすることで一細胞を対象として、細胞の形状、細胞周辺の酸素濃度、細胞膜の透過性などを評価できる技術である。測定では、反応を仲介する物質(メディエータ)を利用することで細胞に触れることなく観察することが可能であり、検出するメディエータなどを変えることで様々な解析項目に対応する(図1)。
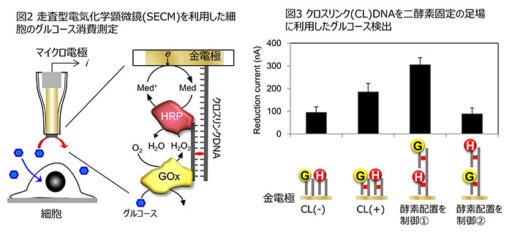
SECM測定を細胞のエネルギー代謝解析に利用するために、プローブであるマイクロ電極に酵素などを固定化し、グルコースなどの代謝物の検出を可能とする技術を開発している(図2)。 ここでは、DNAを固定化酵素の足場とすることで複数酵素の配置を制御し、さらに、DNA二本鎖間をクロスリンク(CL)したDNAを利用することで固定化酵素を安定化している。 開発したプローブの測定例として、グルコースオキシダーゼ(GOx, G)とペルオキシダーゼ(HRP, H)を、様々な配置で固定化した時のグルコースに対する電流応答を図3に示す。 クロスリンクDNAを利用することで酵素の固定化状態が安定化し、検出感度が二種類の酵素の配置に大きく依存していたことから、酵素の配置を分子レベルで制御して検出感度を向上できた。
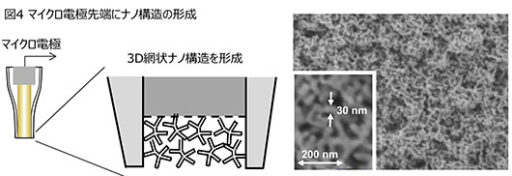
また、マイクロ電極への酵素固定の効率化を目的に、電極表面へナノ構造を形成する技術を開発している(図4)。マイクロ電極を電気化学的に処理することで、太さが20~30ナノメートル程度のナノワイヤーが絡み合ったナノ構造を形成し、実効表面積を約30倍に増加させることができた。
今後、様々な物質の影響によって多様に変化する細胞動態を正確に追跡する技術を開発し、外的因子と細胞動態の因果関係を明らかにし、医薬品評価などに役立たせたいと考えている。
- Hirano Y., Nishimiya Y., Kowata K., Mizutani F., Tsuda S. and Komatsu Y. Construction of Time-Lapse Scanning Electrochemical Microscopy with Temperature Control and Its Application To Evaluate the Preservation Effects of Antifreeze Proteins on Living Cells. Anal. Chem., 80,9349-9354 (2008).
- Hirano, Y., Kowata, K., Kodama, M. and Komatsu, Y. Development of a scanning electrochemical microscopy-based micropipette and its application to analysis of topographic change of single-cell. Bioelectrochemistry, 92C, 1-5 (2013).
- Hirano, Y., Kodama, M., Shibuya, M., Maki, Y. and Komatsu, Y. Analysis of beat fluctuations and oxygen consumption in cardiomyocytes by scanning electrochemical microscopy. Anal. Biochem., 447C, 39-42 (2014).
- Ikegami, M., Hirano, Y., Mie, Y., Komatsu, Y. Fabrication and characterization of nanoporous gold on microelectrode. Journal of Electroanalytical Chemistry., 783, 188-191 (2016).
- Hirano, Y., Ikegami, M., Kowata, K., and Komatsu, Y. Bienzyme reactions on cross-linked DNA scaffolds for electrochemical analysis. Bioelectrochemistry., 113, 15-19 (2017).

